INHIBICIÓN REVERSIBLE DE LAS ENZIMAS
¿QUE ES?
Son moléculas de pequeño tamaño que se unen de forma reversible con la enzima que inhiben. Un inhibidor de enzimas es el que que se enlaza con otras enzimas y interviene su actividad cortando toda conexión entre ellas. Estos tienen la capacidad de actuar para evitar la formación del complejo enzimático.
Todas las células contienen gran variedad de inhibidores enzimáticos naturales, que tienen un gran rol en el proceso del metabolismo. siendo estos de vital importancia para el sentido de la vida. También existe una gran variedad de inhibidores artificiales estos utilizados en laboratorios para experimentos sobre otras rutas de metabolismo, ya que muchos agroquímicos que se conocen en la actualidad su principal función es la inhibición de enzimas y proteínas.
existen otras características como cuando el inhibidor se une en una forma covalente con las enzimas, esto provocando la reacción de la inhibición irreversible. La mayoría de características y reacciones que tiene que ver con el campo biológico son del ámbito de características reversibles.
TIPOS DE INHIBIDORES
Los tipos básicos de inhibición reversible son competitiva, acompetitiva y no competitiva. Se pueden diferenciar de manera experimental por sus efectos sobre el comportamiento cinético de las enzimas.
Ilustración. algunos de los inhibidores más característicos imagen extraída de; file:///C:/Users/20de%20bioqu%C3%ADmica.PDF
INHIBIDORES COMPETITIVOS.
estos inhibidores son los mas comunes en la rama de la bioquímica. En este tipo de inhibición la unión solo se puede dar si la molécula se encuentra libre sin ninguna unión con algún tipo de sustrato. Cuando un inhibidor competitivo se une con una molécula de enzima, una molécula de sustrato no puede unirse a esa molécula de enzima. Al revés, la unión de sustrato y una molécula de enzima evita el enlazamiento de un inhibidor( Principios de la Bioquimica PDF) 2020. existe la inhibición No clásica este tipo de inhibición es característica en las enzimas alostéricas. También existe la clásica, esta se caracteriza por la unión de la enzima en el mismo sitio activo.
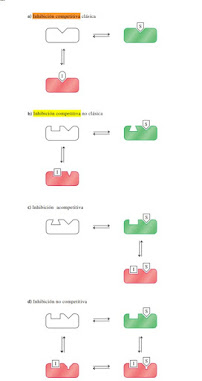
Ilustración 2. Diagramas de inhibición enzimática reversible. En este esquema, las enzimas catalíticamente competentes están en gris claro y las enzimas inactivas están en gris oscuro. a) Inhibición competitiva clásica. S e I se unen al sitio activo en una forma mutuamente excluyente. b) Inhibición competitiva no clásica. La unión de S con el sitio activo evita la unión de I a un sitio separado y viceversa. c) Inhibición acompetitiva. I se une sólo al complejo ES. La enzima se inactiva cuando se enlaza con I. d) Inhibición no competitiva. I se puede unir a E o a ES. La enzima se inactiva cuando se enlaza I. Aunque al complejo EI pueda unirse todavía S, no se forma producto. Principios de la Bioquimica PDF (2020).
INHIBICIÓN ACOMPETITIVA
En la inhibición acompetitiva, el inhibidor no se une en el mismo sitio que el sustrato, pero su unión al enzima aumenta la afinidad del sustrato por el enzima, dificultado su disociación e impidiendo la formación de los productos. Este tipo de inhibición es común que se presente en las reacciones de multisustrato
INHIBICIÓN NO COMPETITIVA
En la inhibición no competitiva, el inhibidor no bloquea la unión del sustrato con el sitio activo, sino que se pega a otro sitio y evita que la enzima haga su función. Se dice que esta inhibición es no competitiva porque el inhibidor y el sustrato pueden estar unidos a la enzima al mismo tiempo.
Si un inhibidor es no competitivo, la reacción catalizada por la enzima jamás llegará a su velocidad de reacción máxima normal, incluso en presencia de mucho sustrato. Esto se debe a que las moléculas de enzima que están unidas al inhibidor no competitivo están "envenenadas" y no pueden hacer su función, independientemente de la cantidad disponible de sustrato.
FUENTES.
Enzyme inhibitor. (Inhibidor enzimático; 10 de mayo de 2016). Consultado el 10 de Octubre de 2020 en Wikipedia: https://en.wikipedia.org/wiki/Enzyme_inhibitor.
H. Robert Horton 2008. North Carolina State University, Principios de la Bioquimica PDF CUARTA EDICIÓN. pg 12 cap.13.
.






No hay comentarios:
Publicar un comentario