ENZIMA ARN POLIMERASA
Son las enzimas capaces de sintetizar ARN, y encargadas de llevar a cabo la transcripción.(Richard H. Ebright 2000) Existen varias tipos de ARN polimerasas, aunque la más importante, por su función y su cantidad en la célula es la ARN polimerasa II de eucariotas, que es la que sintetiza los ARN mensajeros que serán traducidos a proteínas en el retículo endoplasmático
En las células eucariotas
el ARN polimerasa se divide en
3 tipos:
a)
Las
de tipo I son las encargadas de la síntesis y reparación del ARN propio de los
ribosomas.
b)
La
ARN pol II, como ya hemos comentado, es la encargada de la síntesis y
reparación de los ARN mensajeros y otros tipos de ARN de muy pequeño tamaño de
los que se están empezando a estudiar su función y origen, los microARNs.
c)
La
ARN pol III de eucariotas es la encargada de la síntesis de los ARN de
transferencia, encargados de presentar los aminoácidos a los ribosomas y
también sintetizan los ARN ribosómicos 5S, que se encuentran en la región que
interviene en el reconocimiento de los ARN de transferencia.
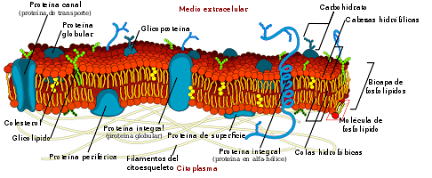
Ilustración 1. la estructura de la RNA-polimerasa II
de levaduras. El centro activo lo puedes localizar en el centro de la proteína
gracias a la presencia del átomo de Mg. Cada subunidad está representada de un
color diferente. En torno al Mg contactan las dos subunidad. Imagen Extraida de: https://www.sebbm.es/BioROM/contenido/av_bma/apuntes/T11/RNApol.htm
Ilustración 2. tabla donde se muestra las características de localización y actividad de la ARN. Imagen extraída de:https://www.sebbm.es/BioROM/contenido/avbma/apuntes/T11/RNApol.htm
En los procariotas, bacterias y arqueas, la única variante de ARN polimerasa con la que cuentan realiza todas las funciones que en eucariotas llevan a cabo de forma más especializada diferentes ARN pol.(Richard H. Ebright 2000) Esta enzima tiene una menor cantidad de subunidades que la eucariota, tan solo 5 La ARN pol de arqueas y bacterias es muy similar entre ellas y respecto a las ARN pol de eucariotas las más parecidas a las procariotas son la I y la IV. Además los cloroplastos y las mitocondrias, que tienen su propio ADN cuentan con sus propias ARN pol, diferentes de las eucariotas y más emparentadas con las de las bacterias de las que derivan estos orgánulos celulares.
Video donde se explica la Enzima ARN dependiente de ARN polimerasa. Bioquímica.
1. Richard H. Ebright 2000, RNA Polymerase: Structural Similarities Between Bacterial RNA Polymerase and Eukaryotic RNA Polymerase II Journal of Molecular Biology, Volume 304, Issue 5, 15 December 2000, Pages 687-698 Tomada de Wikipedia el 11 de noviembre de 2020.